成果概况
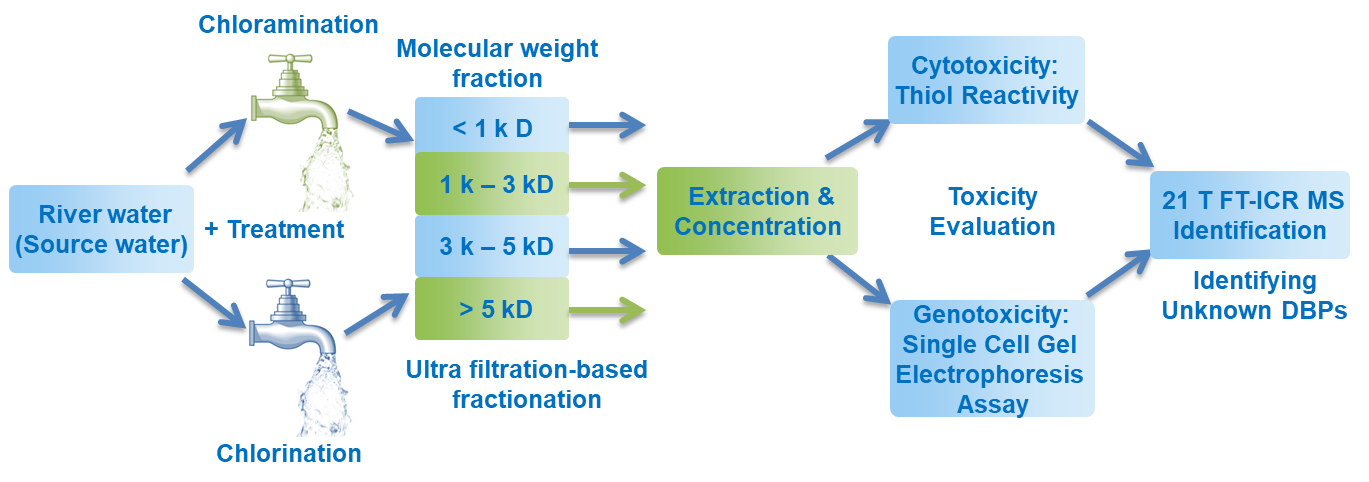
饮用水中大分子DBPs(>2C)的分子组成尚未得到有效表征,且其在DBPs中的毒性贡献难以评估。本研究基于“效应导向”分析(EDA)发现饮用水经过氯或氯胺消毒后,在 <1 kD, 1-3 kD, 3-5 kD, 和 >5 kD不同分子量范围的DBPs中,<1 kD部分表现出最高水平的细胞毒性和基因毒性。对氯后水和氯胺后水<1 kD部分DBPs进行高分辨质谱解析,识别出未知Cl-DBPs共3599个,相对丰度CHOCl > CHOCl2 >> CHOCl3。由于氯胺的“缓释效应”,在氯胺消毒后的水中解析出更多未知Cl-DBPs(<1 kD),已知DBPs相对较少。除此之外,在识别出的DBPs中,随着氯原子个数增加,O/C呈现上升趋势,而芳香指数AImod表现出下降趋势。富含羧基和酚羟基的NOM(一般表现为高O/C和高AImod)可能是这些未知Cl-DBPs的前体物。在水处理中,有针对性的去除这部分NOM有利于控制已知和未知DBPs的生成。
研究背景
至今,已有> 700种DBPs被识别,但在氯和氯胺消毒后的水中,仍有~50%和~70%的TOX未被识别,而这些未知的TOX中包含着大量有待识别的高毒性DBPs。未知DBPs识别的一大挑战在于从复杂的水背景基质中识别出对饮用水毒性有显著贡献的部分。尽管GC-MS识别出的多数DBPs是小分子(1-2C)的(半)挥发物质,这并不意味着“毒理因子”就在其中。基于LC-MS和HRMS的分析方法已经识别出越来越多的亲水性大分子DBPs。
作为DBPs的前体物,NOM是由水环境中不同极性、挥发性、分子量的复杂有机化学物质组成的,DBPs也可能具备同样多元的化学特性。之前的研究表明,饮用水中非挥发性DBPs往往表现出更高的总体毒性,因此,饮用水的总体毒性可能是由个别几种组分带来的,但具体的“毒理因子”尚不明确。本研究首次通过“生物测试导向”的水样分级方法开展“效应导向”分析(EDA),将复杂的天然水体分为几种不同性质的组分,利用HRMS非靶向识别“高毒性组分”中的DBPs。
研究结果
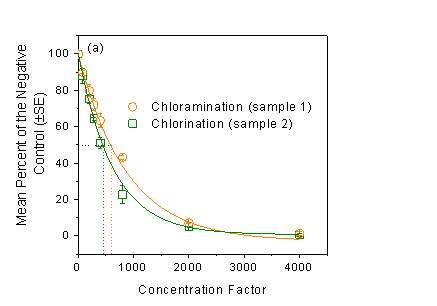
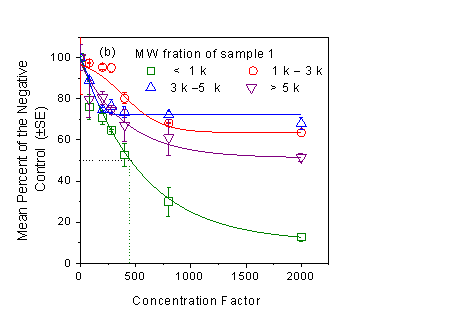
巯基反应性可以预测饮用水样品的CHO细胞毒性。氯后水(sample 2)的巯基反应指数(TRI = EC50 -1)是氯胺后水的1.3倍(sample 1),表明氯后水的毒性略高于氯胺后水。氯胺后水根据分子量分级后发现,<1 kD部分的EC50值远低于其他三部分,表明 <1 kD部分是毒性最高的组分。
图1(a)氯胺(sample 1)和氯(sample 2)消毒后饮用水的细胞毒性;(b)基于分子量分级的氯胺消毒后饮用水(sample 1)的细胞毒性。(点划线为读取EC50值示意图,误差棒为3次平行。)
从单细胞凝胶电泳实验(SCGE)的剂量-效应曲线上可以看出,饮用水经过氯或氯胺消毒后,基因毒性最高的部分为 <1 kD部分。在氯胺后水中,<1 kD部分的基因损伤效应高于高分子量部分(> 1kD),这和巯基反应性实验结果相符。其基因毒性指数(GTI)比1-5 kDa部分高4倍。整体看来,氯或氯胺消毒后水中 <1 kD部分DBPs会造成显著的基因毒性和细胞毒性,可能对公共健康造成负面影响,应进一步解析其化学组成。
图2基于分子量分级的(a)GA氯后水的基因毒性(sample 7);(b)TX河水(sample 4)和氯胺后水(sample 5)的基因毒性。图2a中,仅在 <1 kD部分, 1-3 kD部分和全水样中观测到CHO细胞的DNA损伤。<0.5 kD和 >5 kD部分没有基因毒性。“水样体积当量(Equivalent Water Volumn)”指和富集后水样含有同等质量有机物的原始水样体积。受样品体积限制,sample 7每个浓度只做2次平行。
在氯和氯胺消毒后水中检测出8类已知DBPs。氯后水中已知DBPs的总体浓度高于氯胺后水。THMs(28.5 – 42.3 μg/L)和HAAs(21.4 – 32.1 μg/L)是已知DBPs检出浓度最高的DBPs,其次是HALs,TCAL浓度最高达6.5 μg/L。N-DBPs(HNMs,HANs和HAMs)也有检出,浓度均低于5.0 μg/L,表明原水中存在N-DBPs前体物。
图3氯胺(sample 1)和氯(sample 2)消毒后水中已知DBPs的检出浓度。(2次平行)
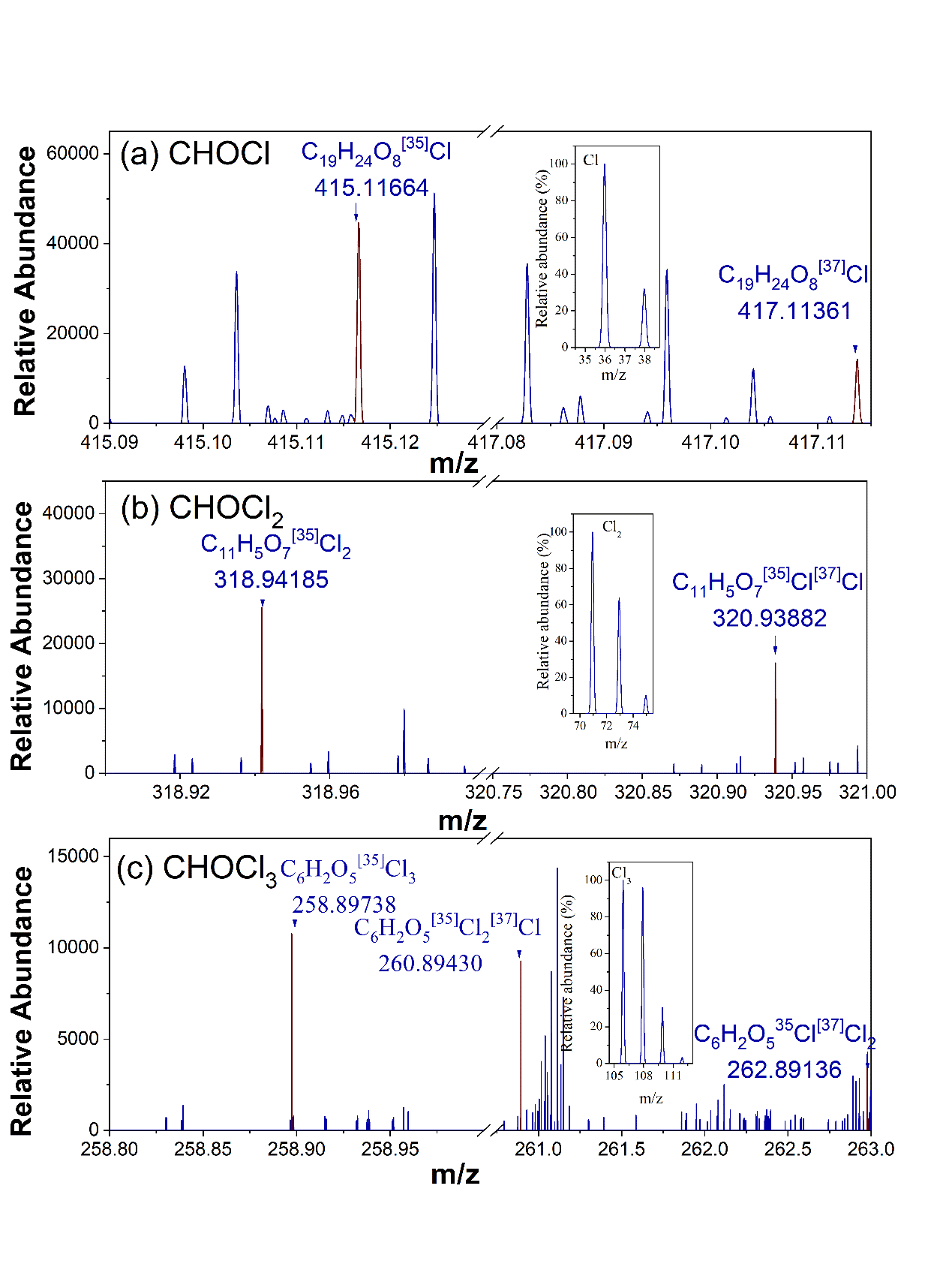
利用FT-ICR MS进一步分析了未知大分子Cl-DBPs高毒性部分(< 1kD)的分子级特征。为进一步提高分子式匹配的准确率,对已识别的CHOCl,CHOCl2和CHOCl3 DBPs分子进行了同位素校核。在氯和氯胺消毒后水中共检测出3599个Cl-DBPs分子。
图4 FT-ICR MS在氯胺消毒后水(sample 1)中识别出的大分子CHOCl,CHOCl2和CHOCl3 DBPs的同位素校核。小窗显示了含一个Cl37原子的CHOCl,CHOCl,CHOCl2和CHOCl3分子式的理论谱图。检测分子式和计算分子式之间的质量差∆m控制在11-25ppb。
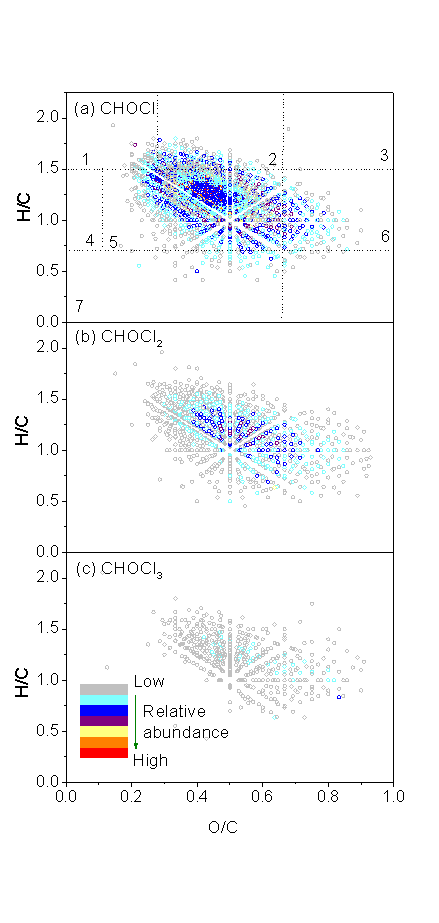
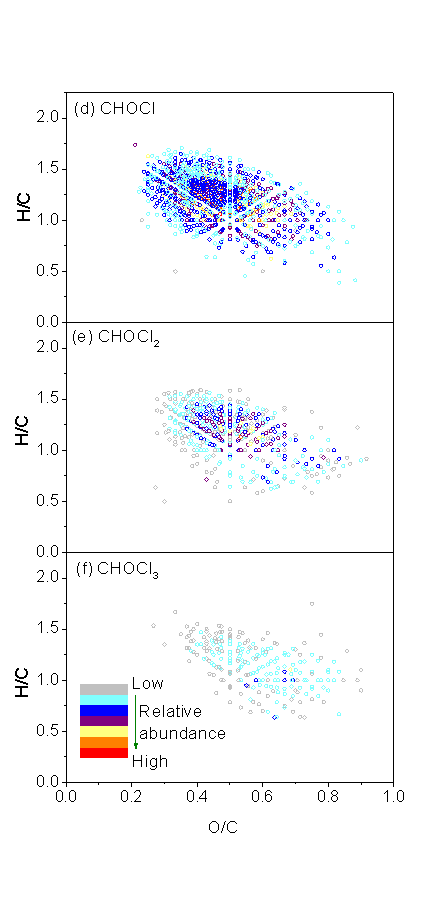
在检出的3599个Cl-DBPs中,有1847个CHOCl分子,1243个CHOCl2分子和509个CHOCl3分子,分子数量和相对丰度均符合CHOCl > CHOCl2 > CHOCl3的规律。氯胺后水中检出的未知Cl-DBPs多于氯后水,在氯胺消毒后水中检出3423个Cl-DBPs分子,而在氯后水中仅检出2155个Cl-DBPs分子。这些Cl-DBPs在vk图上有相似的分布规律,主要分布在木质素类/含羧基芳香类物质区域,0.1 < O/C < 0.67, 0.7 < H/C < 1.5。随着Cl原子个数增加,CHOCl1-3分子的分布规律发生改变。例如,主要分布区域从木质素类/含羧基芳香类物质转移到丹宁类物质区域,表明NOM中的丹宁类物质(高O/C)可能是含多个Cl原子DBPs的前体物。
图5在氯胺(a, b和c, sample 1)和氯(d,e和d,sample 2)消毒后水中检测出大分子CHOCl,CHOCl2和CHOCl3 DBPs(<1 kD部分)的vk图。随着圆圈颜色由灰变红,样品中DBPs的相对丰度增加。图5a中的1-7区域分别代表(1)脂类;(2)脂肪类/多肽类;(3)碳水化合物类;(4)不饱和烃类;(5)木质素类/含羧基芳香类;(6)丹宁类和(7)芳香类物质。
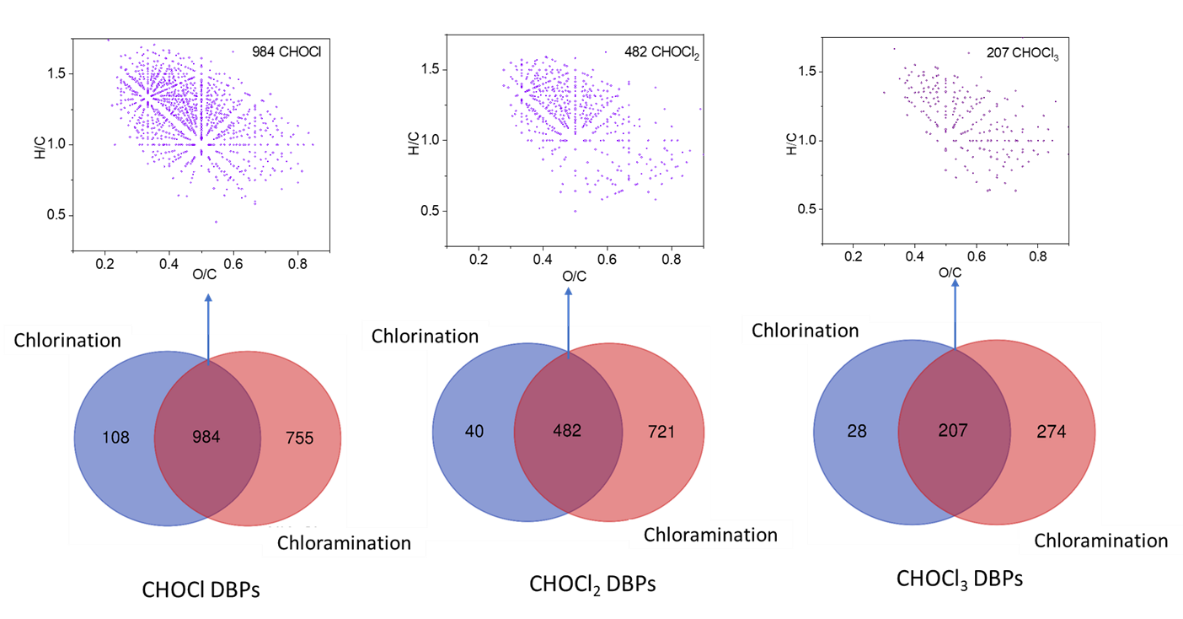
大多数氯后水中检出的CHOCl(90%),CHOCl2(63%)和CHOCl3 (69%)DBPs在氯胺后水中也有检出,而在氯胺后水检出的CHOCl,CHOCl2和CHOCl3 DBPs中,分别有~60%,40%和40%在氯后水中被检出。由于两个样品原水相同,CHOCl1-3 DBPs的检出种类可以反映不同消毒剂(氯和氯胺)对TOX和DBPs的生成影响。氯胺化过程形成的DBPs,也是由HOCl和NOM之间的反应生成的,所以氯后水和氯胺后水中的DBPs种类相近。但由于NH2Cl水解为HOCl过程缓慢,氯胺化过程可能生成更多未知大分子DBPs(>2C),而非已知小分子DBPs(1-2C)。
图6在氯胺(sample 1)和氯(sample 2)消毒后水中均有检出的大分子CHOCl,CHOCl2和CHOCl3 DBPs(<1 kD部分)
环境意义
本研究基于“效应导向”分析(EDA)发现饮用水经过氯或氯胺消毒后,分子量 <1 kD部分的DBPs表现出最高水平的细胞毒性和基因毒性,是饮用水毒性的主要贡献者。对该部分DBPs进一步的高分辨质谱解析表明,相较于氯化过程,氯胺化过程形成了更多未知CHOCl1-3 DBPs而非THMs和HAAs等受控DBPs。为减少饮用水消毒过程中已知和未知DBPs的生成,高O/C和AImod的NOM应该在水处理过程中得到控制。在未来,更多的研究应着眼于高毒性贡献的未知DBPs生成转化机制。
主要作者简介
董慧峪,中科院生态环境研究中心副研究员,中科院饮用水重点实验室副主任,中科院特聘研究骨干。研究方向为饮用水消毒副产物水质风险控制,以第一/通讯作者在Acc. Chem. Res.、Environ. Sci. Technol.、Water Res.、Chem. Eng. J.、J. Hazard. Mater.等发表论文38篇。担任中国科学院大学岗位教师、中国矿业大学兼职教授、南宁市饮用水科学与技术工程中心副主任,Frontier in Environmental Science副主编,Chemosphere、Water专刊主编,《中国给水排水》青年编委,环境水质学国家重点实验室青年创新小组组长等。获第四届消毒副产物控制研讨会优秀口头报告三等奖、水处理化学与新技术研讨会最佳论文奖、广西科学技术自然科学类三等奖等学术奖励。
撰稿:董慧峪
审阅:庄媛、黄鑫
校核:祝贵兵
原文链接:
https://pubs.acs.org/doi/abs/10.1021/acs.est.3c00771