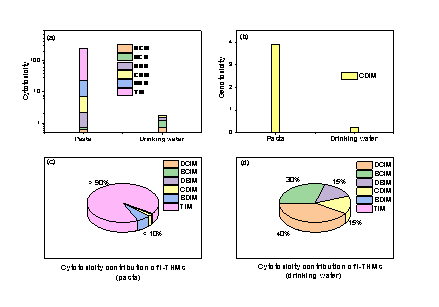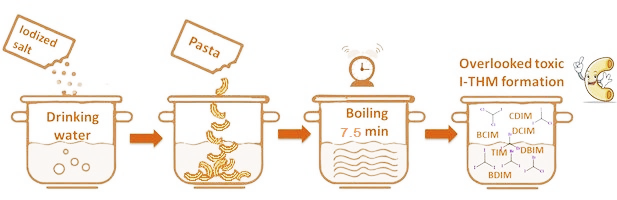
成果概况
我们发现在烹饪过程中,龙头水中残留的氯胺可以和加碘盐中的碘以及意面中的有机物反应生成碘代消毒副产物(I-DBPs)。因此,本研究首次调查了用加碘食盐和氯胺消毒的饮用水烹煮意面过程中I-DBPs的生成情况。首先,建立了乙酸乙酯萃取、Captiva EMR-Lipid小柱清洗、加标校正、GC-(MS)/MS检测的分析方法降低意面中其他有机物对I-DBPs检测的干扰。实验发现,意面-水混合物中的总I-THMs浓度为11.1 ng/g,其中TIM和CDIM的浓度分别为6.7 ng/g和1.3 ng/g。意面-水混合物中I-THMs的计算细胞毒性和基因毒性分别是龙头水的126倍和18倍。把意面-水混合物分离后发现,意面中有更低水平的I-THMs和计算毒性,且CDIM是主要的I-THMs。本研究强调了I-DBPs暴露的另一种途径。同时发现,烹煮意面时敞开锅盖和烹煮意面后添加加碘盐可以避免I-DBPs的生成。
研究背景
氯和氯胺是目前最常用的饮用水消毒剂。化学消毒往往会引起DBPs的生成,其中,I-DBPs因其远高于受控的THMs和HAAs的毒性而受到关注。在饮用水中,原水中天然存在的碘和人为排放的造影剂中的碘都是I-DBPs潜在的前体物。加碘盐是另一种潜在的碘暴露途径。饮用水中残余的消毒剂可能和食盐中的碘以及食物中的有机物反应生成I-DBPs。
烹饪过程中I-DBPs的生成最近已经引起广泛关注。但是之前的研究是在模拟的烹饪条件下进行的,没有用真实的食品进行实验。食物基质含有的有机物可能影响DBPs的生成,并且会干扰痕量I-DBPs的检测,因此,应首先开发出一种可以检测食物样品中I-DBPs的方法。除此之外,烹饪过程中DBPs的生成可能被食物类型、消毒剂种类浓度、盐种类等诸多因素影响。所以,有必要在实际的烹饪场景下探究I-DBPs的生成情况。
本研究开发了可以定量检测食物样品中6种I-THMs和IAN的分析方法,评估了用加碘盐和氯胺消毒后的饮用水烹煮意面时,I-DBPs的生成情况,并提出了可以降低I-DBPs水平的烹煮方式。
研究结果
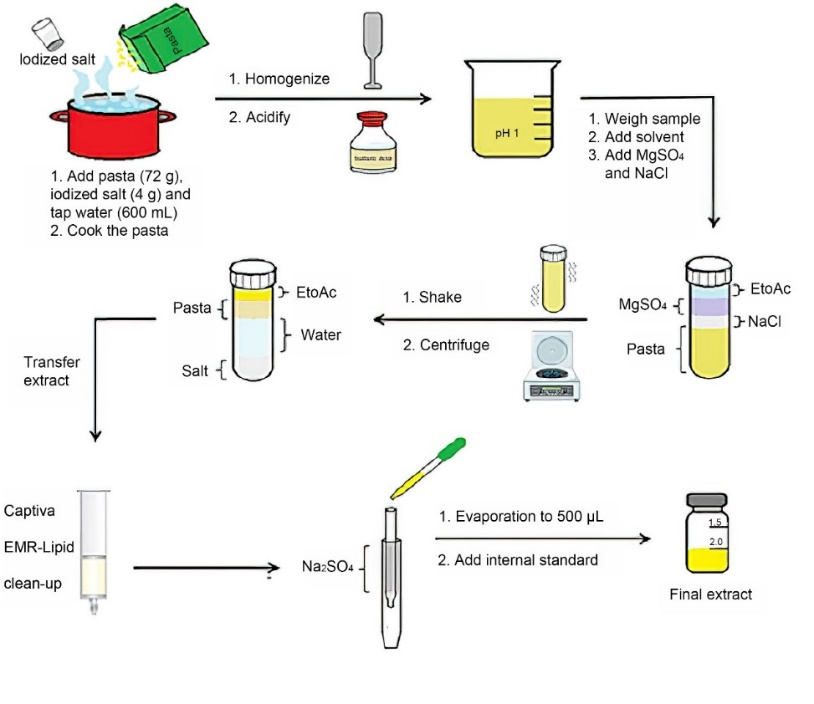
意面烹煮方式和I-DBPs萃取方法如图1所示。相较于乙腈,乙酸乙酯萃取出的背景组分相对较少,且气相色谱的峰形更好。但用乙酸乙酯萃取I-DBPs仍会将意面中一些非极性的背景组分一同萃取出来,这些组分在气相色谱中的沉积会导致方法的重复性较差,因此萃取液需要选用合适的吸附剂清洗。
图1意面烹煮和用以I-DBPs分析的样品预处理、萃取、清洗流程。
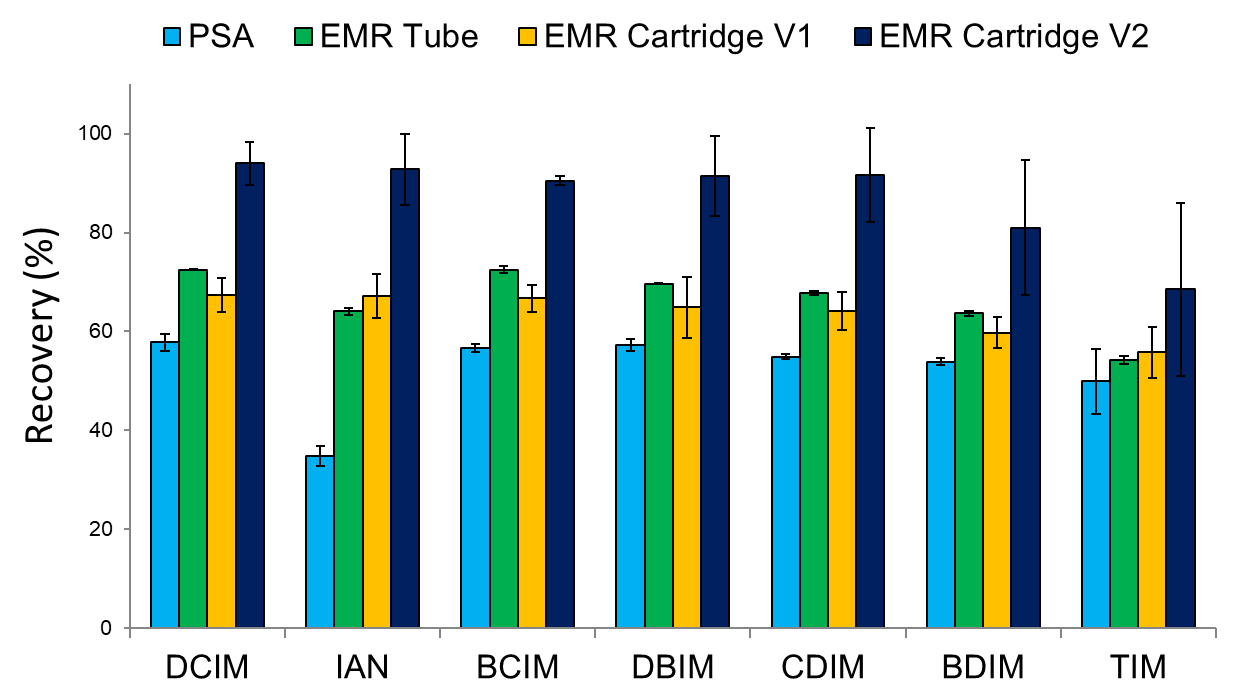
选用的三种吸附剂(PSA, EMR-Lipid, 和Captiva EMR-Lipid)虽然都可以去除一定的背景组分,保证方法的重复性,但是利用EMR清洗后背景组分的色谱响应更低。通过对I-THMs和IAN回收率计算发现(图2),EMR小柱清洗两次,得到的回收率最高。
图2方法对目标I-THMs和IAN的回收率(萃取液清洗后)
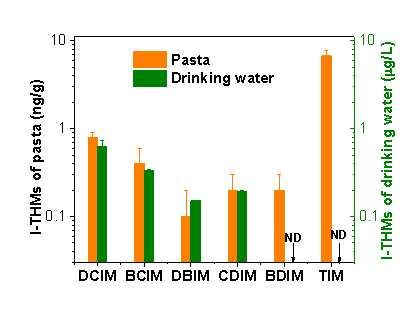
利用该方法,分析了意面烹煮过程中的I-DBPs生成情况。饮用水中,DCIM是主要的I-THMs;而在意面-水混合物中,TIM是含量最高的I-THMs。DCIM,IAN,BCIM,DBIM,CDIM和BDIM的浓度分别为0.7,0.05,0.5,0.6,1.3和0.3 ng/g(图3),表明加碘盐烹煮意面过程中生成的I-DBPs是I-DBPs通过食物暴露的另一种途径。另外,在饮用水中并未检测到BDIM和TIM的生成,说明这两种I-DBPs是通过意面和加碘盐以及含氯胺的饮用水之间的反应生成的。同时,除了BCIM和DCIM,其他四种I-THMs在意面中的水平远高于其在饮用水中的水平。在对应的控制实验中,当采用不含碘的食盐时,6中I-THMs均无检出,进一步证实了加碘盐中的碘对意面烹煮过程中I-THMs生成的贡献。
图3意面-水混合物(ng/g)和饮用水样品(μg/L)中的的I-THMs浓度(ND:无检出)。烹煮条件:加碘盐浓度6.7 g/L; 烹煮时间7.5 min; 加盐时刻0 min; 食盐种类:加碘盐1 (121 μg/L I- + 112 μg/L Br-); 氯胺浓度~1 mg/L。
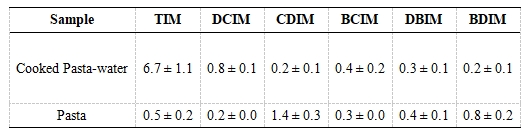
将意面从意面-水混合中分离出来后,6种I-THMs的分布表现出不同的趋势(表1)。DBIM,BDIM和CDIM在意面中I-THMs的占比大于50%,而TIM和DCIM的占比低于20%。整体上看,在意面(3.6 ng/g)中检出的总I-THMs比意面水混合物(8.6 ng/g)中的更低,只有30%I-THMs留在了意面中。在意面-水混合物中,主要的I-THMs是TIM;在意面中主要的I-THMs是CDIM。
表1意面-水混合物和意面中的I-THMs浓度(ng/g)
6种I-THMs的细胞毒性符合TIM > BDIM > DBIM > CDIM ≈ BCIM > DCIM的规律,只有CDIM有基因毒性。如图4(a)和4(b),意面-水混合物中I-THMs的计算细胞毒性和基因毒性分别是龙头水的126倍和18倍。在意面-水混合物中,尽管6种I-THMs均有检出,TIM贡献了大于90%的细胞毒性(图4(c)),而在饮用水中,DCIM,BCIM,CDIM,DBIM的计算细胞毒性贡献分别为40%,30%,15%和15%(图4(d))。因此,TIM是意面-水混合物中计算细胞毒性的主要驱动因子,CDIM是意面-水混合物和饮用水中计算基因毒性的主要驱动因子。
图4意面-水混合物和饮用水中I-THMs的计算细胞毒性(a),计算基因毒性(b),意面-水混合物(c)和饮用水(d)中I-THMs的相对计算细胞毒性。
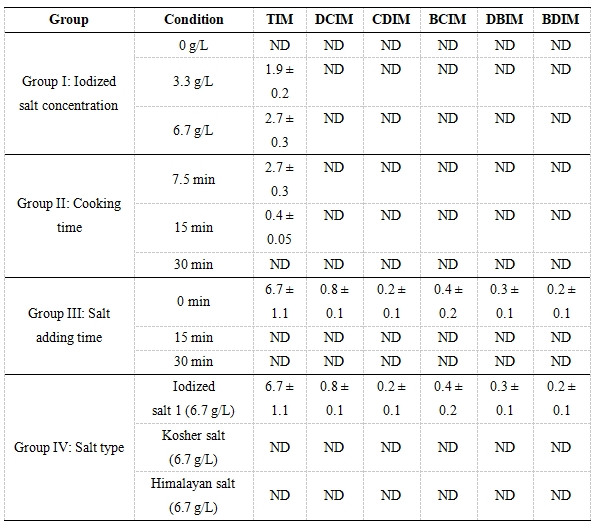
本研究设计了四组实验来探究食盐浓度(I组),烹煮时间(II组),加盐时刻(III组)和食盐种类(IV组)对I-THMs生成的影响(表2)。当初始加碘盐浓度为3.3 g/L时,TIM浓度为1.7 μg/L,而且总I-THMs生成量和食盐浓度之间有正相关关系(R2 > 0.90)。从组II来看,当烹煮时间从建议的7.5 min延长到15 min和30 min时,7.5 min时刻I-THMs的浓度总是高于15 min和30 min时刻的浓度。
表2不同烹煮条件下意面-水混合物中I-DBPs的浓度(ng/g)。基本烹煮条件(除特别说明):加碘盐浓度6.7 g/L; 烹煮时间7.5 min; 加盐时刻0 min; 食盐种类:加碘盐1 (121 μg/L I- + 112 μg/L Br-); 氯胺浓度~1 mg/L。
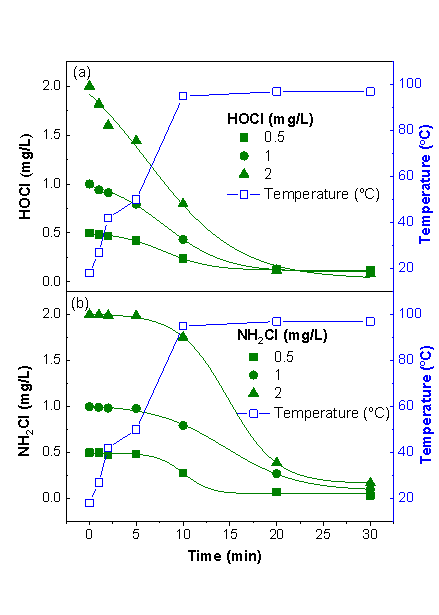
避免消毒剂、加碘盐和食品在水中的同时存在是控制I-THMs生成的有效举措。如图5所示,当水温从18升到98 oC,氯和氯胺浓度均迅速衰减。尽管氯胺衰减速率比氯慢,但烹煮10 min后,氯胺浓度可降至初始浓度的20%以下。如表2 所示,当在15 min和30 加入加碘盐时,没有I-DBPs检出。因此,通过调整加入加碘盐的时刻,可以避免I-DBPs的生成。在组IV中,当采用了不含碘的食盐时(kosher和Himalayan),没有I-THMs被检出,表明选用不含碘的食盐也是控制I-DBPs生成的有效途径。
图5在烹煮过程中HOCl(a)和NH2Cl(b)的加速衰减过程。HOCl和NH2Cl的初始浓度为0.5-2 mg/L。
环境意义
本研究首次开发了一种可以检测意面中I-DBPs浓度的分析方法,并用其探究了用加碘盐烹煮意面过程中I-DBPs的生成情况。意面-水混合物中的I-THMs主要是TIM,其计算细胞毒性和基因毒性是饮用水的126倍和18倍。然而,当把意面从混合物中分离后发现,CDIM是意面中主要的I-THMs,且总I-THMs浓度比混合物中低58%。因此,本研究发现了I-DBPs暴露的另一种方式,即在用加碘食盐烹煮意面过程中导致的I-DBPs的生成和摄入。为控制I-DBPs带来的健康风险,可在烹煮结束后加盐或者使用不含Br/I的食盐(如kosher 或Himalayan)。
主要作者简介
董慧峪,中科院生态环境研究中心副研究员,中科院饮用水重点实验室副主任,中科院特聘研究骨干。研究方向为饮用水消毒副产物水质风险控制,以第一/通讯作者在Acc. Chem. Res.、Environ. Sci. Technol.、Water Res.、Chem. Eng. J.、J. Hazard. Mater.等发表论文38篇。担任中国科学院大学岗位教师、中国矿业大学兼职教授、南宁市饮用水科学与技术工程中心副主任,Frontier in Environmental Science副主编,Chemosphere、Water专刊主编,《中国给水排水》青年编委,环境水质学国家重点实验室青年创新小组组长等。获第四届消毒副产物控制研讨会优秀口头报告三等奖、水处理化学与新技术研讨会最佳论文奖、广西科学技术自然科学类三等奖等学术奖励。